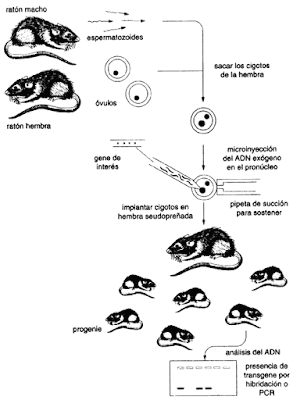
¿Qué es la biología sintética?
La biología sintética combina la biología molecular y la biología de sistemas con principios de ingeniería para el diseño de sistemas biológicos y biofábricas & El objetivo es crear mejores funciones biológicas para superar los desafíos actuales y futuros.& Creemos que la biología sintética cambiará nuestra forma de crear energía, producir alimentos y optimizar el procesamiento industrial, además de detectar, prevenir y curar enfermedades. Nuestro compromiso es contribuir con las mejores tecnologías y soluciones disponibles en el mercado a esta comunidad de investigación. A través de la ciencia y la ingeniería, esta área única permite a los investigadores estudiar, modificar, crear y recrear itinerarios, secuencias de ADN, genes y sistemas biológicos naturales altamente complejos para dar respuesta a algunas de las preguntas más difíciles de la vida.
Los peligros de la edición genómica
Los líderes de la genética mundial alertan contra la “reacción en cadena” que permite propagar genes por toda una población
Una foto del mosquito que transmite la malaria posado en una persona, y en la que se ve la sangre en su abdomen. CDC
Entre las aplicaciones de la revolucionaria técnica
 |
| mosquito transportando la malaria |
El impulso genético (gene drive) es en realidad un fenómeno que existe en la naturaleza, y hay científicos que piensan que es importante para la especiación, o generación de nuevas especies en la evolución. Nuestras células tienen dos copias de cada gen, y cada una tiene un 50% de probabilidad de pasar a la descendencia. Pero hay genes que manipulan ese juego justo y aumentan sus probabilidades. A lo largo de las generaciones, incluso una pequeña ventaja puede bastar para que ese gen se imponga en la población.
El gen artificial introducido por en investigador en el organismo sigue activo, y es capaz de convertir al gen natural que tiene enfrente en una copia de si mismo. El proceso no para nunca, y es tan eficaz que propaga el gen artificial por toda la población en pocas generaciones. De ahí su apodo de “reacción en cadena.
Y lo que ofrece la técnica de edición genómica crispr/cas al gen tramposo no es
naturales de, por ejemplo, los mosquitos que transmiten la malaria y otras enfermedades que son un grave problema de salud pública en los países en desarrollo.
Los científicos, entre ellos muchos líderes del campo, recomiendan que estos experimentos se sometan a una batería de medidas de confinamiento que impida su escape accidental y propagación por la naturaleza
También se proponen erradicar a las especies invasivas que se han introducido –por error, descuido o un mal evaluado interés económico— en ecosistemas que pueden sucumbir a ellas. Y controlar las plagas más dañinas para la agricultura, como una alternativa al uso extensivo de pesticidas que dañan al medio y a los polinizadores naturales como abejas y abejorros.
Son fines nobles, pero mientras se desarrollan estos métodos, existe el riesgo obvio de que los insectos manipulados se escapen al campo y armen una catástrofe ecológica.
Video
Opinión
Los líderes de la genética mundial alertan contra la “reacción en cadena” que permite propagar genes por toda una población son fines nobles, pero mientras se desarrollan estos métodos, existe el riesgo obvio de que los insectos manipulados se escapen al campo y armen una catástrofe ecológica, son fines nobles, pero mientras se desarrollan estos métodos, existe el riesgo obvio de que los insectos manipulados se escapen al campo y armen una catástrofe ecológica.
Referencias: